Izotopai
Elemento atominė masė yra suma protonų ir neutronų masių viename to elemento atome. Kiekviena iš šių dalelių sveria 1 atominį vienetą. Elektronai sveria gerokai mažiau nei protonai ar neutronai, ir dėl to jų masę galima ignoruoti bandant apskaičiuoti elemento atominę masę.
Jeigu žvilgtertume į vieną anglies–12 atomą, galime suskaičiuoti, jog jis turi 6 neutronus ir 6 protonus, ir tai reigštų jog jo anglies masė turėtų būti 12, bet periodinėje lentelėje atominė masė parašyta 12.011. Periodinėje lentelėje nurodyta masė yra vidutinė masė. Tai reiškiasi kad anglis turi izotopus – elementus kurie turi tą patį skaičių protonų, bet skirtingą skaičių neutronų. Vienas pavyzdys anglies yra parodytas apačioje:
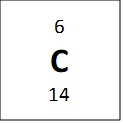
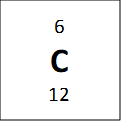
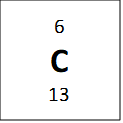
Visi viršuje esantys elementai yra vadinami anglimi, nes jie visi turi 6 protonus, bet jie turi skirtingas mases. Vidutinė masė 12.011 amu (atominis masės vienetų) yra randama žiūrint į procentinę kompozicija naturialios anglis mėginyje (98.9% 12C, 1.1% 13C ir labai maža dalis (kurią galima ignoruoti) 14C). Tad kai pasveriam mases pagal procentus mes gaunam masę, kuri parodyta periodinėje lentelėje:
12 × 0,989 + 13 × 0,011 = 11,868 + 0,143 = 12,011