Difuzija ir efuzija
Kaip jau išmokote iš kinetinės molekulių teorijos (žr. kinetinės molekulių teorijos pamoką), dujų molekulės visą laiką juda atisitiktine kryptimi. Dėl to kai dvi skirtingos dujos maišosi, jos po truputi maišysis iki kol suformuos vienatęsi mišinį. Šis procesas yra difuzija.
Panašiai, ir kai dujų pripildytas konteineris turi mažą skylutę per kurią dujų molekulės gali ištrūkti, nes molekulės juda atsitiktine tvarka, dujos ištrūks kad užplidyti kitą erdvę ir šis procesas vadinasi efuzija. Konteineryje esančioms dujoms efuzijos greitis gali būti apskaičiuotas pagal Grahamo taisyklę:
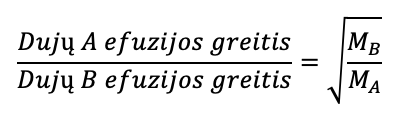
MA = molinė masė dujų A
MB = molinė masė dujų A
Kaip galite pamatyti iš Grahamo taisyklės viršuje, dujų efuzijos greitis yra apverstinai proporcingas šakniai iš dujų molinės masės. Taip yra todėl kad sunkesnės molikulės turi mažesnį greitį nei lengvesnės molekulės toje pačioje temperatūros, net jei ir abi turėtų tą pačią vidutinę kinetinę energiją (žr. kinetinės molekulių teorijos pamoką). Dėl to difuzija ir efuzija yra greitesnė lengvesnėms dujoms.